Cell重磅:铁死亡进入全新领域——铁死亡导致人类大脑神经元丢失,为痴呆症治疗打开新思路
来源:生物世界 2025-12-06 16:23
该研究探索了一种极其罕见的人类早发性神经退行性疾病——塞达加蒂安型脊柱干骺端发育不良中的 GPX4 基因突变,发现 GPX4 抑制铁死亡的关键不仅在于其“酶活性”,更在于其“在细胞膜上的正确定位”。
多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
其中,铁死亡(Ferroptosis)是于 2012 年发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。与此同时,细胞中也有多个对抗铁死亡的途径(尤其是癌细胞)——例如 GPX4 所介导的通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡。
实际上,在“铁死亡”这一术语被提出之前,德国亥姆霍兹慕尼黑研究中心 Marcus Conrad 教授团队就已揭示了 GPX4 通过阻止细胞和小鼠中无限制的磷脂过氧化,调控一种新的非凋亡细胞死亡类型。
2025 年 12 月 4 日,Marcus Conrad 教授团队在国际顶尖学术期刊 Cell 发表了题为:A fin-loop-like structure in GPX4 underlies neuroprotection from ferroptosis 的研究论文。
该研究探索了一种极其罕见的人类早发性神经退行性疾病——塞达加蒂安型脊柱干骺端发育不良(SSMD)中的 GPX4 基因突变,发现 GPX4 抑制铁死亡的关键不仅在于其“酶活性”,更在于其“在细胞膜上的正确定位”。其致病突变 GPX4R152H 会破坏这种膜定位,即使酶本身仍有活性,也无法发挥神经保护作用,从而诱发神经元铁死亡,引发严重的早发性神经退行性病变。
这项研究从一个罕见疾病入手,首次提供了分子证据,表明铁死亡可直接驱动人类大脑中的神经退行性病变,并进一步揭示了一个普适性的重要生物学机制,确立了铁死亡是神经退行性病变的关键驱动因素,将靶向铁死亡推到了神经退行性疾病治疗的舞台中央。

神经退行性疾病(例如阿尔茨海默病、帕金森病、亨廷顿病等)是一组多样化的病症,其特点是认知能力下降、运动障碍,在很多情况下会甚至会导致过早死亡,神经元的逐渐丢失是这些疾病的一个反复出现的显著特征。
近年来,我们在识别神经退行性疾病的遗传风险和病理标志物方面取得了许多进展,但对于神经元是如何走向死亡的仍缺乏深入的、机制性的理解,尤其是关于神经元死亡的上游通路,这也成为了开发神经退行性疾病有效疗法的主要障碍。
谷胱甘肽过氧化物酶-4(GPX4),是一类含有硒元素的硒酶,在人体内主要参与抗氧化、代谢调节等重要作用。如今,GPX4 被公认为是铁死亡的核心调控因子,保护细胞免受铁死亡。
GPX4 的致病基因突变,与塞达加蒂安型脊柱干骺端发育不良(SSMD)有关,这是一种极其罕见的常染色体隐性遗传疾病,自 1980 年首次有临床病例报告以来,全世界至今仅有少数几例病例被报道,所有病例均指向了 GPX4 基因突变。患儿表现出脊椎和长骨生长区域的严重骨骼畸形,以及严重的神经系统异常,导致患儿通常在婴儿早期死亡。
铁死亡是由细胞膜上的磷脂发生过氧化反应驱动的,而 GPX4 被公认为是铁死亡的“守护者”,传统观点认为,其保护作用主要依赖于它的酶活性,即清除脂质过氧化物的能力。
在这项研究中,研究团队研究聚焦于导致人类早发性神经退行性疾病 SSMD 的 GPX4 基因突变——GPX4R152H。GPX4 中的一个鳍环样(fin-loop-like)结构将其锚定在细胞膜上,这个鳍环样结构会嵌入细胞膜中,GPX4 沿着细胞表面滑动,从而迅速地清除脂质过氧化物。而 GPX4R152H 突变使鳍环样结构塌陷,虽不显著影响 GPX4 的酶活性,但会破坏 GPX4 锚定在细胞膜上的能力。GPX4 必须物理上靠近它要保护的细胞膜(即发生脂质过氧化的现场),其保护功能才能有效发挥,仅仅有酶活性是不够的。
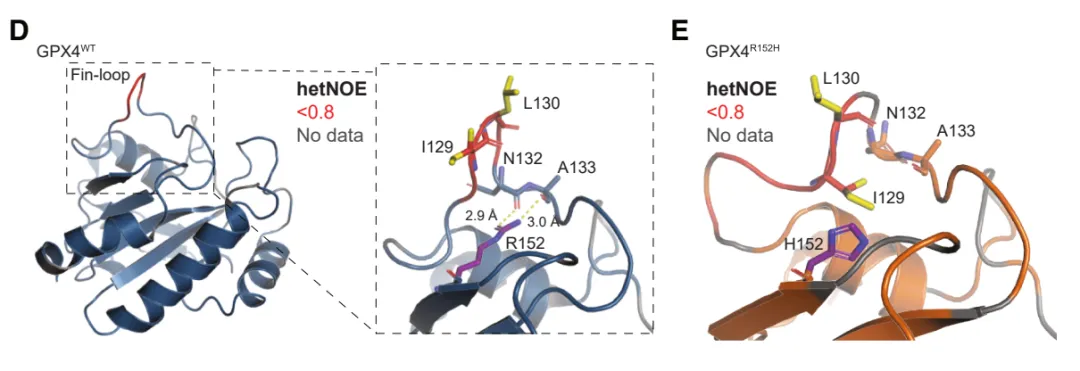
在小鼠中,敲除 Gpx4 基因或特异性表达人类 GPX4R152H 突变基因,都成功引发了大脑皮层和小脑的神经元死亡和神经炎症,模拟了人类 SSMD 疾病的病理过程。
利用人类 SSMD 患者来源的 iPSC 培育出皮质神经元和更复杂的前脑类器官,这些细胞同样表现出对铁死亡的易感性升高。更重要的是,铁死亡抑制剂可以有效保护这些细胞,证明了铁死亡是直接的死亡原因,并提示了治疗潜力。
研究团队进一步分析了实验模型大脑中哪些蛋白质的丰度发生了变化,结果观察到一种与阿尔茨海默病患者中极为相似的模式——许多在阿尔茨海默病中表达上调或下调的蛋白质,在 GPX4 功能缺失的小鼠大脑中也同样出现了表达失调。这表明,铁死亡可能不仅在 SSMD 这种罕见的早发性神经退行性疾病中发挥作用,很可能还在阿尔茨海默病等更常见的痴呆症中发挥作用。
这些发现凸显了 GPX4 的正确膜定位的必要性,确立了铁死亡是神经退行性病变(包括阿尔茨海默病)的关键驱动因素,并为将靶向铁死亡作为神经退行性疾病的治疗策略提供了理论依据。
该研究的核心发现:
GPX4 中鳍环样(fin-loop-like)结构将其锚定在细胞膜上以阻止铁死亡;
GPX4R152H 突变使鳍环样结构塌陷,损害其神经元保护功能;
患者来源的神经元和类器官表现出铁死亡驱动的神经退行;
小鼠模型证实,GPX4 功能缺失与阿尔茨海默病样特征有关。
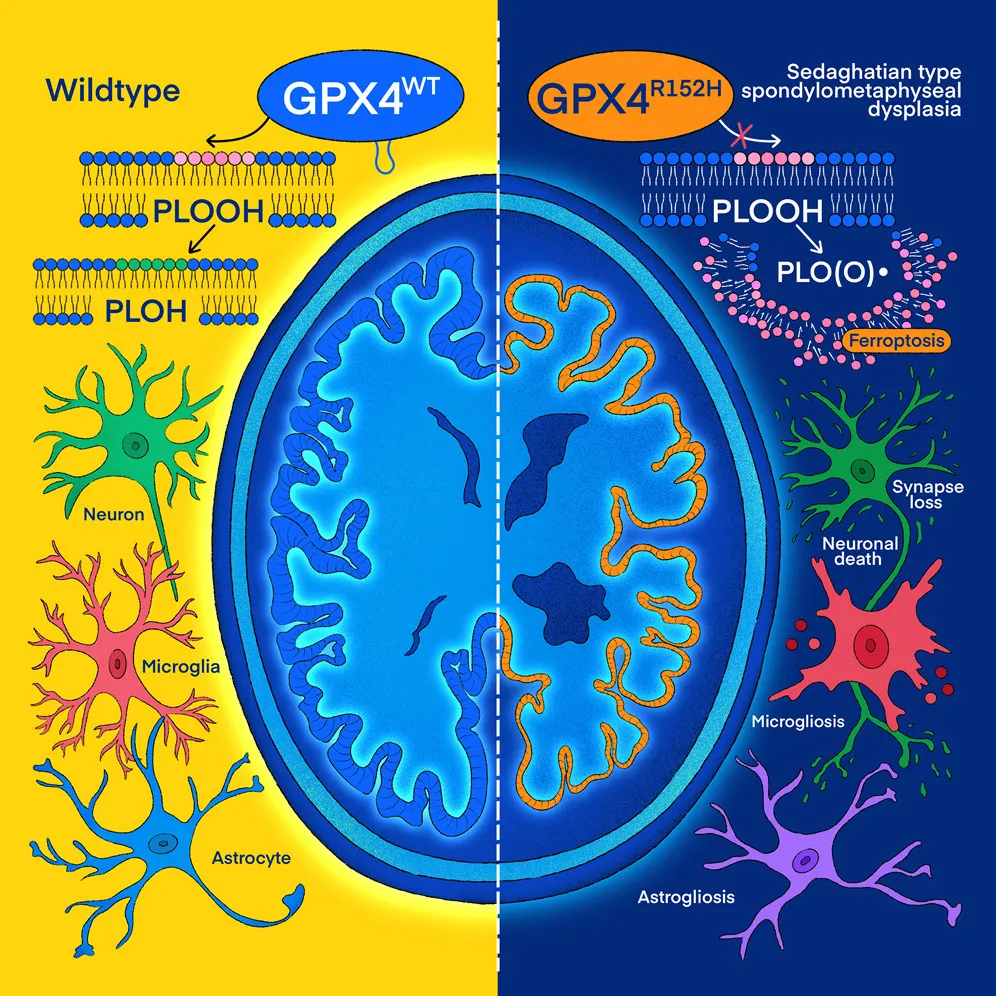
总的来说,这项研究深化了对 GPX4 作用机制的理解,明确了其“膜定位”与“酶活性”同等重要;确立了铁死亡在神经退行性疾病中的核心驱动地位,通过从基因突变到动物模型、再到人类细胞模型的完整证据链,证明了铁死亡足以导致神经退行性变。这项研究还揭示了抑制铁死亡具有神经保护作用,为开发针对阿尔茨海默病等神经退行性疾病的疗法提供了强有力的理论依据和新方向。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)01310-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


